Organogel
Un organogel est un gel physique, c'est un matériau solide, non cristallin et non vitreux composé d'un liquide organique piégé dans un réseau tridimensionnel complexe.

Catégories :
Gel - Chimie supramoléculaire - Chimie organique physique - Polymère organique - Polymère
Recherche sur Google Images :
Source image : fr.wikipedia.org Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
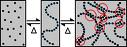
- ... Français : Schéma illustrant la formation d'un organogel via deux équilibres : l'un de désolvatation des organogélateurs, ... (source : commons.wikimedia)
Un organogel[1] est un gel physique, c'est un matériau solide, non cristallin et non vitreux composé d'un liquide organique piégé dans un réseau tridimensionnel complexe. Le liquide peut être, par exemple, un sovant organique, une huile minérale ou une huile végétale. La solubilité, la morphologie et les dimensions des structures formant le réseau sont des caractéristiques importantes à l'égard des propriétés physiques de l'organogel. Fréquemment, ces dispositifs sont basés sur l'auto-assemblage supramoléculaire de petites molécules organiques : les organogélateurs[2], [3], en des structures le plus souvent fibrillaires[4]. Ces objets ont une longueur de l'ordre du micron et une section de l'ordre de la dizaine de nanomètres.
Ces gels se forment pour des concentrations de quelques pourcents en masse en organogélateur et sont thermoréversibles. Leur viscosité est supérieure de 6 à 10 ordres de grandeur comparé à celle du solvant seul et ils présentent le plus souvent un comportement rhéofluidifiant : leur viscosité diminue sous l'effet d'un cisaillement. De par ces propriétés, les organogels sont utilisés dans des domaines aussi nombreux que variés tels que la pharmaceutique[5], la cosmétique[6], la conservation d'œuvres d'art[7], et l'alimentation[8]. Un exemple de formation indésirée de tels gels est la cristallisation du pétrole en cire[9].
Formation d'un organogel
Un organogel est préparé le plus souvent en chauffant un organogélateur dans un liquide organique jusqu'à dissolution totale du solide, puis en laissant refroidir la solution (sol) en dessous de la température de gélation : transition sol-gel. C'est-à-dire la température en dessous de laquelle le matériau ne coule plus même à des temps longs. Le matériau résultant est un gel plus ou moins pâteux ; la description formelle et la classification de ces gels est basée sur leurs propriétés rhéologiques. Les agrégats colloïdaux (dont les dimensions typiques sont comprises entre 2 et 200 nm) dans le gel sont liés dans des réseaux tridimensionnels complexes qui immobilisent le liquide organique sur une étendue variable grâce essentiellement à la tension de surface. Malgré les nombreuses études présentes et passées sur ce phénomène, plusieurs questions importantes restent sans réponse. Sous quelles conditions une molécule est un organogélateur ? Quelle est la relation, s'il y en a une, entre l'empilement des molécules à l'état cristallin et leurs divers agrégats dans l'état de gel ? Quelle est l'influence des auto-assemblages supramoléculaires des organogélateurs sur les propriétés thermodynamiques, mécaniques, optiques... des gels ? Toutes ces questions sont tournées vers un unique objectif pratique : comment prévoir si et sous quelles conditions un organogel se forme. Le moyen le plus efficace pour une petite quantité de gélateur d'immobiliser une grande quantité de liquide est d'adopter une structure fibrillaire. La structure des agrégats linéaire dans le gel est déterminée par la direction et la force des liaisons associées au processus d'agrégation. Tandis que dans l'eau, les attractions hydrophobes jouent un rôle majeur dans la formation des agrégats (micelles... ) [10], elles ne sont plus significatives quand on se trouve en solvant organique, l'agrégation dans les organogels résulte d'autres interactions[11], [12], [13].
Interactions moléculaires
Les organogélateurs sont capables de gélifier toute sorte de solvants organiques même à des concentrations massiques assez faibles (moins de 1% en masse). Pour qu'une aussi petite quantité de molécules puisse former le gel, l'enthalpie des interactions entre organogélateurs doit être assez stabilisante pour balancer la diminution de l'entropie qui accompagne la réduction des degrés de liberté du dispositif. Dans les liquides organiques les forces attractives sont essentiellement les interactions dipolaires et , si les organogélateurs le permettent, peuvent rentrer en jeu les forces de Van der Waals, les interactions π, les forces solvophobes, mais aussi les liaisons hydrogène intra ou intermoléculaires.
Un groupe important d'organogélateurs utilise les liaisons H comme force motrice de l'auto-assemblage supramoléculaire ; en font partie les amides[14], les urées[15], les dérivés peptidiques[16], les pepsipeptides [17] ou les structures peptidomimétiques [18], sucres[19] et alcools[20]. Ces molécules peuvent être vues comme des dispositifs à deux acteurs : une partie donneuse de liaisons H responsable de la cohésion de la supra-structure et une partie qui facilite la solubilité de la molécule et l'unidirectionnalité des liaisons, et empêche sa cristallisation. Cependant une molécule possédant un ou plusieurs groupements amide n'est pas obligatoirement un organogélateur et vice versa, d'autres interactions peuvent entrer en jeu comme il a été dit plus haut. C'est le cas par exemple des stéroïdes[21], cholestérol et dérivés[1], dérivés aromatiques[22], et même des molécules plus simples telles que des alcanes[23] ou alcanes semi-fluorés[24].
Malgré ces assertions il est toujours particulièrement complexe de prévoir si une molécule est un organogélateur et quel liquide organique elle peut gélifier, pour cause, l'absence à ce jour de relation structure/activité[1]. Des variations particulièrement subtiles de la structure d'un gélateur peuvent se traduire par un changement drastique de ses propriétés gélifiantes ou de la stabilité du gel[25]. Des organogélateurs sont découverts continuellement mais sont fréquemment le fruit du hasard[1], ils n'en sont pas moins particulièrement nombreux et leur nombre croît d'année en année.
Techniques de caractérisation
Les classes d'organogélateurs
Il n'est pas encore envisageable d'établir à priori si telle molécule va gélifier tel solvant. Les organogélateurs existant ont été découverts, pour la majorité, de manière fortuite. Ils ont été néanmoins scindés en plusieurs groupes caractéristiques.
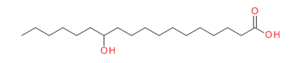
Les dérivés d'acides gras
De nombreux dérivés d'acides gras tels que l'acide 12-hydroxyoctadecanoïque (ou acide 12-hydroxystéarique) et ses sels correspondants sont connus pour créer des matériaux solides à partir de liquides organiques[26]. Des dispersion semi-solides de stéarate de lithium dans l'huile sont utilisées depuis des décennies dans l'industrie des lubrifiants[27], [28]. Dans les graisses lubrifiantes[28], le réseau 3D constitué par les agrégats de ces molécules agit comme une éponge, désormais le composant lubrifiant : l'huile, au contact des régions de friction entre surfaces métalliques[29] dans les dispositifs mécaniques. La totalité de liquides organiques pouvant être gélifiés par cette famille d'organogélateurs est particulièrement vaste, il couvre des alcanes, tétrachlorométhane et solvants aromatiques à des fluides plus polaires tels que le nitrobenzène. La cinétique de la transition sol-gel montre un début net du module d'élasticité. G'et G" sont virtuellement indépendant de la fréquence de sollicitation et l'amplitude de G'est grande (3700 Pa à C∼0, 35%). La présence d'un centre stéréogène, ce qui est le cas dans l'acide stéarique et les sels correspondants, induit des agrégats chiraux ce qui n'est pas nécessairement le cas dans la phase cristalline. Les techniques de dichroïsme circulaire montrent en effet une réflexion préférentielle de la lumière polarisée ce qui est relié à la chiralité des fibres. Généralement, l'arrangement moléculaire des gélateurs dans les fibres du gel et dans les phases cristallines ne doit pas être reconnu comme semblable[30].
Les dérivés de stéroïdes
Les dérivés d'anthryles
Gélateurs contenant des cycles aromatiques
Aminoacides
Composés organométalliques
Organogélateurs mixtes
Systèmes à deux composants
Domaines d'application
Les organogélateurs sont dans un premier tempss utilisés pour leurs propriétés rhéomodifiantes dans des domaines aussi nombreux que variés tels que la peinture[6], la cosmétique[6], l'alimentaire[6], la pharmacologie[31], les lubrifiants[32] ou les explosifs[33]. Un autre type d'application tire avantage de leur état de dispersion et leur microstructure généralement. Ils sont utilisés comme agents clarifiants et nucléants de polymères, en catalyse, et peuvent aussi servir de gabarit pour élaborer des matériaux mésoporeux[34]. Une autre application d'actualité est la récupération de pétrole en cas de fuite par condensation de ses hydrocarbures en boulettes d'une trentaine de centimètres de circonférence[35].
Notes et références
- Terech, P. ; Weiss, R. G. Chem. Rev. 1997, 97, 3133-3159. Van Esch, J. H. ; Feringa, B. L. Angew. Chem. , Int. Ed. Engl. 2000, 39, 2263-2266. R. G. Weiss, P. Terech. Springer, Dordrecht, The Netherlands. 2006.
- Terech P. Low-molecular weight organogelators. In : Robb ID, editor. Specialist surfactants. Glasgow : Blackie Academic and Professional, p. 208–268 (1997).
- van Esch J, Schoonbeek F, De Loos M, Veen EM, Kellog RM, Feringa BL. Low molecular weight gelators for organic solvents. In : Ungaro R, Dalcanale E, editors. Supramolecular science : where it is and where it is going. Kluwer Academic Publishers, p. 233–259 (1999).
- Rolf Schmidt, Fahuzi B. Adam, Marc Michel, Marc Schmutz, Gero Decher and Philippe J. Mésini. Tetrahedron Letters, 44. 2003, 3171-3174. Diaz, N. ; Simon, F. X. ; Schmutz, M. ; Rawiso, M. ; Decher, G. ; Jestin, J. ; Mésini, P. J. Angewandte Chemie-International Edition. 2005, 44, 3260-3264. Diaz, N. ; Simon, F. X. ; Schmutz, M. ; Mésini, P. Macromolecular Symposia. 2006, 241, 68-74. Nguyen, T. T. T. ; Simon, F. X. ; Schmutz, M. ; Mésini, P. J. Chem. Comm. 2009, 23, 3457-3459.
- Kumar R, Katare OP. Lecithin organogels as a potential phospholipid-structured system for topical drug delivery : A review. American Association of Pharmaceutical Scientists PharmSciTech 6, E298–E310 (2005).
- J. F. Toro-Vazquez, J. A. Morales-Rueda, E. Dibildox-Alvarado, M. Charò-Alonso, M. Alonzo-Macias, M. M. Gonzàlez-Chàvez. J. Am. Oil. Chem. Soc. 2007.
- Carretti E, Dei L, Weiss RG. Soft matter and art conservation. Rheoreversible gels and beyond. Soft Matter 1, 17–22 (2005).
- Pernetti M, van Malssen KF, Flöter E, Bot A. Structuring of edible oil by alternatives to crystalline fat. Current Opinion in Colloid and Interface Science 12, 221–231 (2007).
- Visintin RFG, Lapasin R, Vignati E, D'Antona P, Lockhart TP. Rheological behavior and structural interpretation of waxy crude oil gels. Langmuir 21, 6240–6249 (2005)
- Isrælachvili, J. N. Intermolecular and surface forces, 3rd ed. ; Academic Press : London, 1992; pp 341-435.
- Eicke H. F. Topics in Current chemistry; Springer-Verlag : Berlin, 1980; Vol. 87, p 91.
- Bourrel, M. ; Schechter, R. S. Surfactant Science Series; Dekker, M. : New York, 1988; Vol. 30, p 111.
- Ruckenstein, E. ; Nagarajan, R. J. Phys. Chem. 1980, 84, 1349.
- Hanabusa, K. ; Manabu, Y. ; Kimura, M. ; Shirai, H. Angew. Chem., Int. Ed. Engl. 1996, 35, 1949-1951.
- de Loos, M. ; van Esch, J. ; Stokroos, I. ; Kellogg, R. M. ; Feringa, B. L. J. Am. Chem. Soc. 1997, 119, 12675-12676.
- Hanabusa, K. ; Matsumoto, M. ; Kimura, M. ; Kakehi, A. ; Shirai, H. J. Colloid Interface Sci. 2000, 224, 231-244. Menger, F. M. ; Caran, K. L. J. Am. Chem. Soc. 2000, 122, 11679-11691.
- De Vries, E. J. ; Kellogg, R. M. J. Chem. Soc., Chem. Commun. 1993, 238-240.
- Carré, A. ; Le Grel, P. ; Baudy-Floc'h, M. Tetrahedron Lett. 2001, 42, 1887-1889.
- Beginn, U. ; Keinath, S. ; Mœller, M. Macromol. Chem. Phys. 1998, 199, 2379-2384.
- Garner, C. H. ; Terech, P. ; Allegraud, J. J. ; Mistrot, B. ; Nguyen, P. ; deGeyer, A. ; Rivera, D. J. Chem. Soc., Faraday Trans. 1998, 94, 2173-2179.
- Geiger, C. ; Stanescu, M. ; Chen, L. H. ; Whitten, D. G. Langmuir. 1999, 15, 2241-2245.
- Clavier, G. M. ; Brugger, J. F. ; Bouas-Laurent, H. ; Pozzo, J. L. J. Chem. Soc., Perkin Trans. 2 1998, 2527-2534.
- Abdallah, D. J. ; Weiss, R. G. Langmuir. 2000, 16, 352-355.
- Twieg, R. J. ; Russell, T. P. ; Siemens, R. ; Rabolt, J. F. Macromolecules. 1985, 18, 1361-1362.
- Rolf Schmidt, Marc Schmutz, Marc Michel, Gero Decher, and Philippe J. Mésini. Langmuir. 2002, 18, 5668-5672 ; Rolf Schmidt, Marc Schmutz, André Mathis, Gero Decher, Michel Rawiso, and Philippe J. Mésini. Langmuir. 2002, 18, 7167-7173.
- Polishuk, A. T. J. Am. Soc. Lubn. Eng. 1977, 33, 133. Uzu, Y. J. Jpn. Oil Chem. Soc. 1975, 24, 261.
- Fiero, G. W. J. Am. Pharm. Assoc. 1940, 29, 502.
- Boner, C. J. Manufacture and Application of Lubricating Greases; Reinhold Publishing Corp. : New York, 1960.
- Georges J. M. Tribology Series; Elsevier : Amsterdam, 1982; Vol. 7, p 651.
- Ostuni, E. ; Kamaras, P. ; Weiss. R. G. Angew. Chem. Int. Ed. Engl. 1996, 35, 1324.
- Murdan, S. ; Gregoriadis, G. ; Florence, A. T. Eur. J. Pharm. Sci. 1999, 8, 177-186. Murdan, S. ; Gregoriadis, G. ; Florence, A. T. Int. J. Pharm. 1999, 180, 211–214.
- Vold, M. J. ; Vold, R. D. J. Colloid Sci. 1950, 62, 1-19. Hotten, B. W. ; Birdsall, D. H. J. Colloid Sci. 1952, 7, 284-294.
- G. A. Agoston; W. H. Harte; H. C. Hottel; W. A. Klemm; K. J. Mysels; H. H. Pomeroy; J. M. Thompson, Flow of gasoline thickened by Napalm. Ind. Eng. Chem. , 46, 1017-19, 1954 ; K. J. Mysels, Napalm-mixture of aluminum disoaps. Ind. Eng. Chem. , 41, 1435-8, 1949.
- Jung, J. H. ; Ono, Y. ; Hanabusa, K. ; Shinkai, S. J. Am. Chem. Soc. , 2000, 122, 5008–5009.
- Bhattacharya, S. ; Krishnan Ghosh, Y. J. Chem. Soc., Chem. Commun. 2001, 185-186.
Annexes
Liens externes
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 13/12/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité